Proteínas accesorias del HIV-1 que garantizan la supervivencia viral en un ambiente hostil – Parte II
Modulación de las moléculas de la superficie de la célula huésped: Nef y Vpu
Las interacciones de la superficie celular son cruciales el ciclo de vida del virus y para la supervivencia para cualquier parásito intracelular. En el caso del HIV-1, el virus interactúa con los objetivos celulares de la superficie usando el receptor CD4, y los correceptores CCR5 y CXCR4 y sintetizar partículas virales nuevas hasta que son liberadas desde la superficie de células infectadas. Sin embargo, la superficie celular es también donde la respuesta adaptativa inmune reconoce las células infectadas en el contexto de epítopos presentes por complejos mayores de histocompatibilidad de clase I como MHC. Las proteínas Nef y Vpu regulan la actividad, localización, y abundancia de las proteínas de superficie de la membrana en rutas que influencian de manera relevante la replicación viral, la diseminación y la persistencia viral.
Nef es una proteína de 27 kD que juega un papel importante contribuyendo a establecer la magnitud de la infección y la propagación del virus. El ciclo de vida del virus está regulado por Nef. Desde hace bastante tiempo se conoce que la endocitosis en los CD4 desde la superficie de células infectadas es acelerada gracias a la acción de Nef, pero el entendimiento completo de este proceso no es clarividente todavía.
EL HIV-1 también emplea otras proteínas accesorias, como Vpu, para reducir la expresión de las proteínas de membrana de los CD4. Es una proteína integral de membrana de 81 aminoácidos que induce la pérdida de CD4 mediante el reclutamiento de la proteína estructural del complejo ubiquitin-ligasa cullin1-Skp1. Como en el caso de Nef, Vpu interactúa con la cola citoplasmática de los CD4, pero en este caso la interacción con los CD4 ha sido mantenida en el retículo endoplásmico, mediante la unión de la glicoproteína viral Env, gp120, que podría de otra manera regular el tráfico de la superficie celular para la incorporación de partículas virales ensambladas. Vpu se une a un receptor de Skp1, conectando el complejo ligasa a la cola citoplasmática del CD4 y provocando la poliubiquitinación y la degradación proteasomal. En cultivos celulares donde las interacciones de superficie entre CD4 y Env han sido prevenidas mostrando mejoras en la liberación del virus y la incorporación de Env.
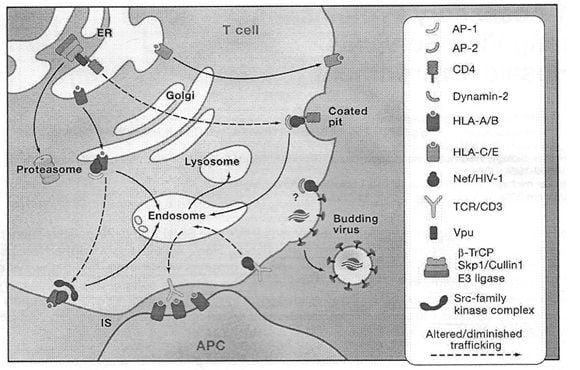
Las MHC clase I, específicamente las HLA-A y los alotipos-B, sufren desregulaciones desde la superficie de las células infectadas por el virus debido a la acción de Nef. Han sido descritas dos mecanismos alternativos (FIGURA 1).
- Nef interactúa con la cola citoplasmática de HLA-A/B y recluta complejos AP1 para variar la ruta de MHC clase I desde el Golgi hasta los endosomas.
- Nef reúne un multicomponente Scr de la familia de las quinasas, provocando una cascada que induce la endocitosis de MHC clase I desde la superficie celular. Parece plausible que podría ser una ventaja selectiva del virus para suprimir la función de MHC clase I con el fin de mitigar la acción citotóxica de las células T (CTL) mediante el reconocimiento de las células infectadas. La habilidad de Nef para desregular las MHC clase I está bien conservada durante la infección y a través de múltiples linajes en lentivirus primitivos.
Un tercer complejo de superficie celular está emergiendo como un objetivo de la regulación de Nef, es el receptor T de las células (TCR-CD3). TCR-CD3 es un componente crítico de la “sinapsis inmunológica” que se forma entre las células presentadoras de antígenos celulares (APCs) y células T para el reconocimiento de antígenos y de la activación de células T. La endocitosis de TCR-CD3 desde la superficie celular y su transporte a través de endosomas es retrasado por Nef.Esto se traduce como una reducción del empaquetamiento de TCR-CD3 en la sinapsis inmunológica, pero también en una formación ineficiente de la sinapsis. FIGURA 1
FIGURA 1. Nef y Vpu regulan la expresión de superficie y la localización de proteínas de la membrana celular.
Los efectos de Nef en las MHC clase I son específicas para HLA-A/B; los alotipos C/E no son afectados por su presencia en la superficie celular y son importantes para la protección de NK.
ER (retículo endoplásmico); IS (sinapsis inmunológica); APC (antígeno presente celular).
Ha sido propuesto que las diferencias en la capacidad de las proteínas Nef a partir de diferentes lentivirus que desregulan a TCR-CD3 puede jugar un papel relevante en expresar lso resultados de patogénesis. Para la mayoría de las proteínas Nef de SIV/HIV estudiadas, la capacidad de desregular TCR-CD3 en células T humanas está relacionado con la falta de la activación y patogenicidad durante la infección en el hospedador natural del correspondiente virus. La acción de Nef del HIV parece ser mas sutil: mientras aparece para regular negativamente el movimiento de TCR-CD3 en la sinapsis, pero no inhibe totalmente la expresión de superficie de TCR-CD3. Perturbando el tráfico de TCR-CD3 de esta forma, la capacidad de las células T para responder a la activación de las señales desde APCs son disminuidas. ¿Por qué se amortiguaría la activación de células T, un proceso que estimula la replicación viral, siendo ventajoso para el virus? Quizás por inhibición de procesos homeostáticos como al apoptosis, Nef puede equilibrar la activación para limitar la eliminación de efectos de la infección en la inmunidad del hospedador, mientras ayuda a asegurar la producción viral y su persistencia.
Nef mejora la infectividad del HIV facilitando la penetración del núcleo viral de la red cortical de actina durante las fases iniciales de la infección. Es evidente que Nef manipula la composición de la superficie de células infectadas en una variedad de vías que pueden beneficiar la propagación viral. Los fenotipos son importantes en el contexto de infecciones naturales, y determinan como se integran unos con otros con respecto a los resultados varios de patogenicidad, evasión inmune, y replicación viral.